臨床研究
Clinical Research

サービス内容
ワンストップサービスを提供しています。
-
臨床研究コンサルティング
- 研究計画におけるエンドポイントの検討、症例数設計、統計解析手法に関するアドバイス
- プロトコル、同意説明文書、症例報告書案等のレビュー、案の作成 等
-
研究事務局業務
- 倫理審査委員会、認定臨床研究審査委員会における申請支援
- 研究登録(jRCT、UMIN等)と更新
- 施設契約書案の作成、契約締結の支援
- 研究資材の作成、発送
- キックオフミーティングの開催
- 研究進捗管理
- 定例会議の運営(会場予約、出欠管理、議事録等の作成等)
- 安全性情報の報告、管理
- 効果安全性評価委員会、症例検討会等の運営 等
-
データマネジメント
- 症例登録、割付の実施
- EDCシステムの構築
- チェック仕様書、チェックプログラムの作成
- データエントリー、データチェック
- クエリの作成、発行、管理
- 薬剤名、疾患名、有害事象等のコーディング
- 症例検討会用資料等の作成
- データ固定 等
-
モニタリング
- 各種手順書の作成
- 施設選定、契約手続き
- 必須文書のSDV
- 症例データと原資料のSDV
- 治験薬管理、安全性情報の収集・提供
- モニタリング報告書の作成 等
-
統計解析
- 解析計画書の作成
- 解析仕様書の作成
- 解析用データセットの作成
- 解析プログラムの作成、帳票出力、バリデーション
- 各種図表の作成
- 中間解析の実施、キーオープン時の解析実施
- 解析報告書の作成 等
-
メディカルライティング
- 論文作成支援(英文・和文)
- 総括報告書の作成支援
- 学会発表資料の作成支援
- 査読対応 等
-
監査
- 監査計画書の作成
- 受託業務監査
- 実施施設監査
- 監査証明書の発行 等
-
レジストリ構築・運用支援
■レジストリのためのデータベース構築支援
- レジストリの目的に則したデータベースのご提案
- データベース構築に特化したプロフェッショナルによる構築運用
- 企業と学会・研究会との橋渡しを担い、円滑なレジストリ立ち上げ支援
■運用支援
- 研究開始から終了までのスケジュール策定・進捗管理
- 事務局業務支援(各種申請支援等)
- データ入力業務支援(施設での入力支援等)
- データマネジメント業務支援(データチェック、クエリ対応等)
- 統計解析業務支援
WDBココの強み
課題解決に向けた柔軟なアプローチを
実現する4つの特徴
Feature.01
高品質と低価格の両立
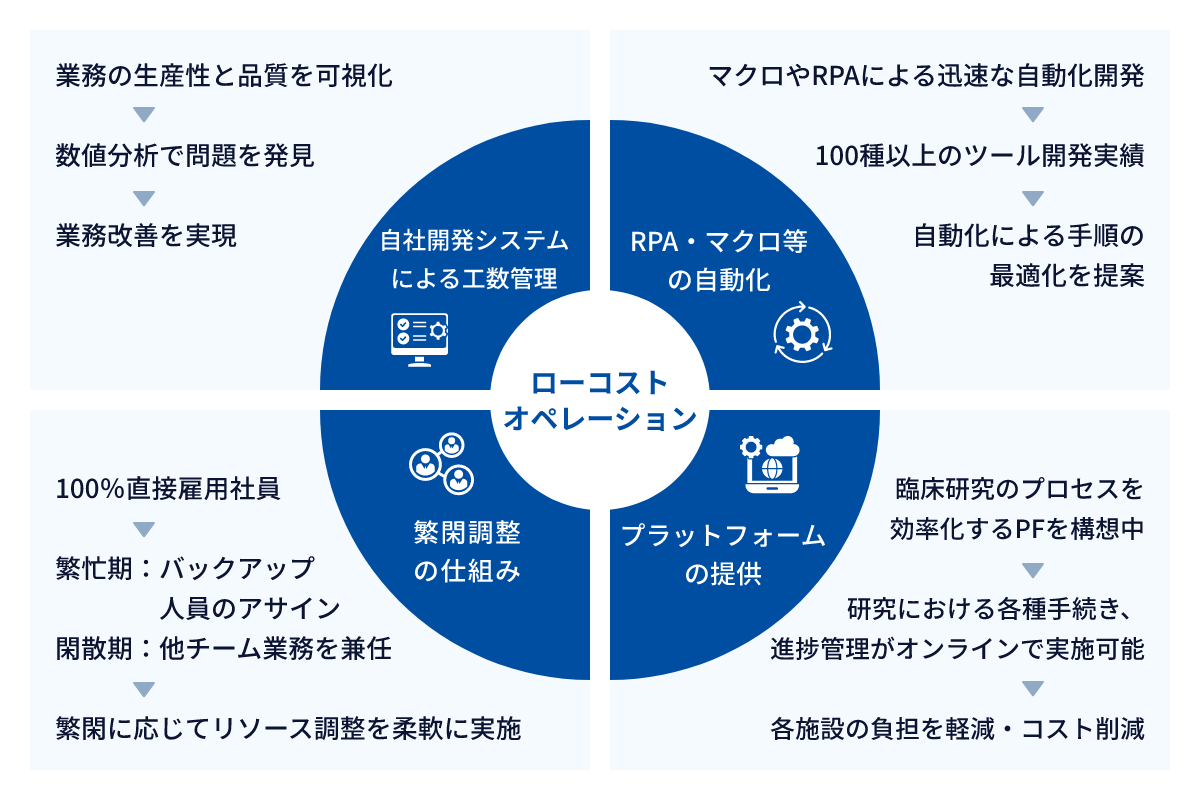
ローコストオペレーションの確立
WDBココでは、自社開発システムによる工数管理、RPA・マクロ等の自動化、繁閑調整の仕組み、プラットフォームの提供により、高品質かつ低価格なサービスを継続的に提供しています。
Feature.02
経験豊富なスタッフ
臨床研究に精通した
経験豊富なスタッフによるサポート
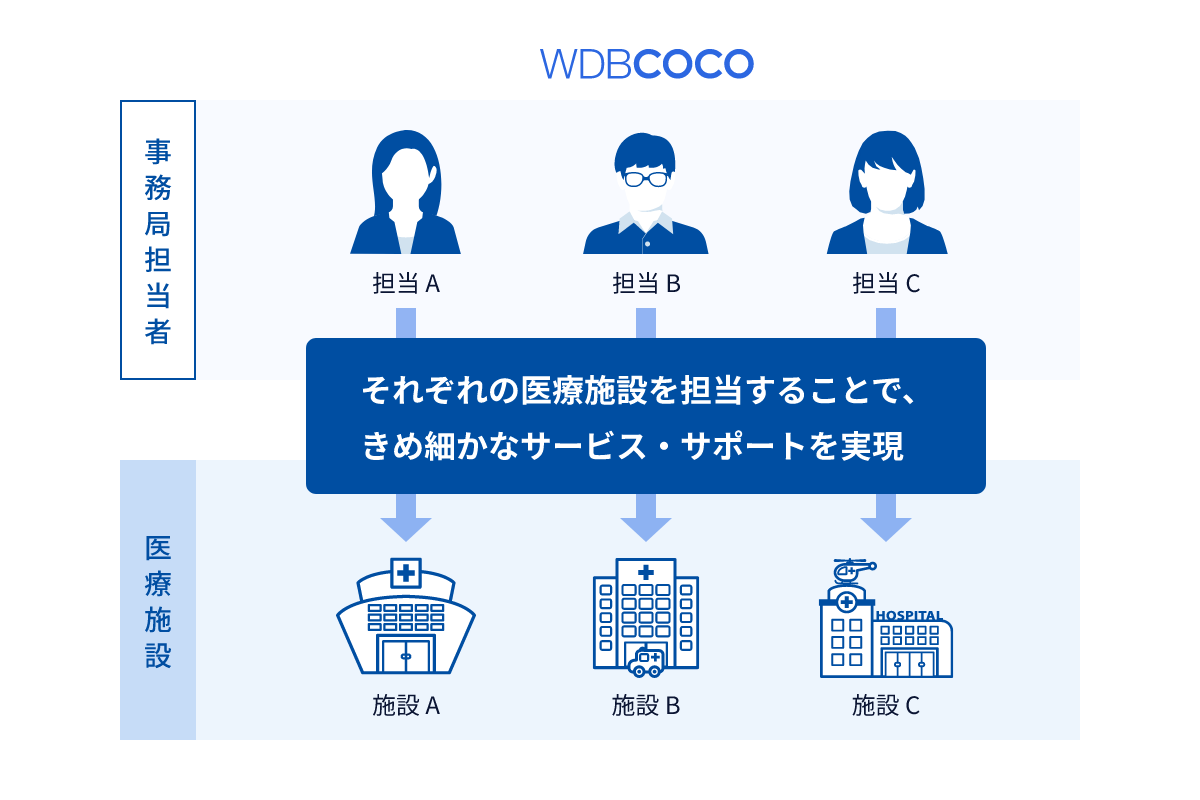
WDBココでは、事務局担当者(クリニカルリエゾンアソシエイト)が、それぞれの医療施設を担当します。臨床研究の手続きや関連法規に精通し、豊富な知識を有したスタッフがきめ細かなサービスを提供します。
Feature.03
ニーズを捉えたサービスメニュー
医師のニーズを研究し開発した
サービスメニュー
診療や会議等で多忙な医師に合わせたサービスメニューを整備しています。
研究説明動画の作成、研究用Webサイトの立上げ等、小回りの利いた手厚いサポートを受けることができます。

Feature.04
ワンストップサービス
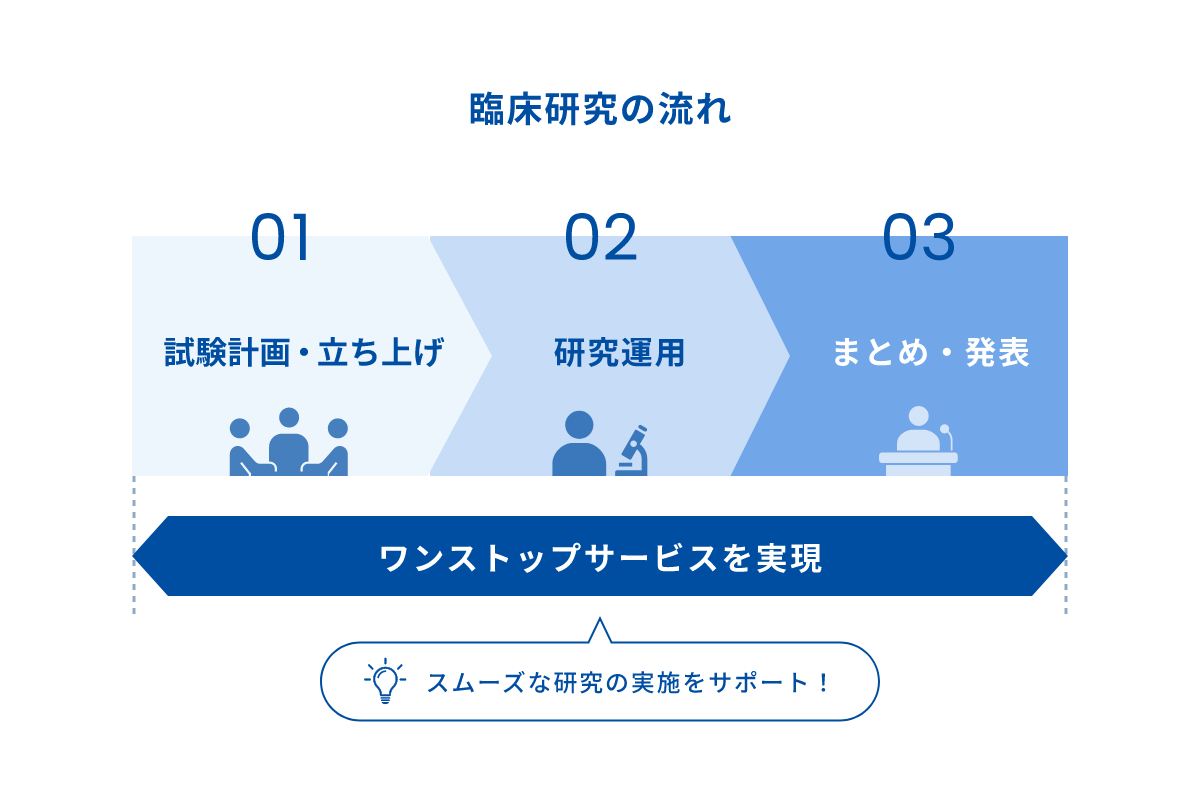
研究企画から論文発表まで
対応可能なワンストップサービス
低コスト・高品質のオペレーションシステムを有するWDBココだからこそ、限られた予算でも臨床研究における一連のサービスを提供可能。
ワンストップでお任せいただくことで、スムーズに研究を実施できます。
サービス
Service