安全性情報管理
Pharmacovigilance

高品質と低価格の両立で
継続的なコスト削減を実現
国内外の臨床試験や、市販後に発生する安全性情報の処理支援業務を受託しています。
発番から入力、評価、報告書案作成、翻訳、ファイリング、文献スクリーニングといったICSRの処理、各種定期報告に至るまで、幅広いサービスラインナップでご期待にお応えします。
一括受託から一部のみの受託、また、お客様の業務変化に応じた多様な支援等、安全性情報管理に関わる様々な業務に対応可能です。
長年にわたって安全性情報管理に携ってきたことによる、多数のお取引実績や豊富な経験を活かし、低価格かつ高品質なサービスを実現させています。
委託先の切替えや新たな業務委託等における様々なリスクを想定の上で体制を整えているため、安心して業務をお任せいただけます。
サービス内容
ICSRの処理から各種定期報告に至るまで、幅広い業務を受託しています。
-
外国症例安全性情報処理業務
(市販後/治験)- 受付、入力、評価、報告書案作成、伝送業務
- 不具合症例の受付、報告書案作成
- 医療機器検討記録評価案作成 等
-
国内症例安全性情報処理業務
(市販後/治験)- 受付、入力、評価、再調査および調査依頼作成、報告書案作成、伝送業務
- CIOMS作成、Globalへの報告
- 医療機関報告に関するFAX対応
- 不具合症例の受付、報告書案作成
- 医療機器検討記録評価案作成
- 調査票原本の管理、月末の回収状況報告
- 提携会社等からの情報入手に対するメール/FAX対応 等
-
文献情報評価業務
- 受付、入力、評価、報告書案作成、伝送業務
- 文献スクリーニング、事象ピックアップ
- 再調査および調査依頼作成
- CIOMS作成、Globalへの報告 等
-
安全性措置情報に関する支援業務
- 措置スクリーニング
- 報告書案作成、伝送業務
- Globalへの報告 等
-
定期報告に関する支援業務
- 感染症定期報告作成支援
- 治験年次報告書作成支援(DSUR)
- 医薬品未知・非重篤副作用定期報告書作成支援
- 安全性定期報告書作成支援 等
-
付随・その他業務
- ファイリング業務
- 市販直後調査(EPPV)支援
- 有害事象詳細調査支援
- 各種翻訳業務
- 安全性情報QA業務(オフラインQC)
- 安全管理責任者のサポート業務 等
WDBココの強み
高品質と低価格を継続的に
両立する4つの特徴
Feature.01
豊富な実績
個別症例安全性報告(ICSR)
受託経験が豊富
WDBココは、安全性情報管理業務の中でも個別症例安全性報告(ICSR)の受託経験が豊富なCROです。

Feature.02
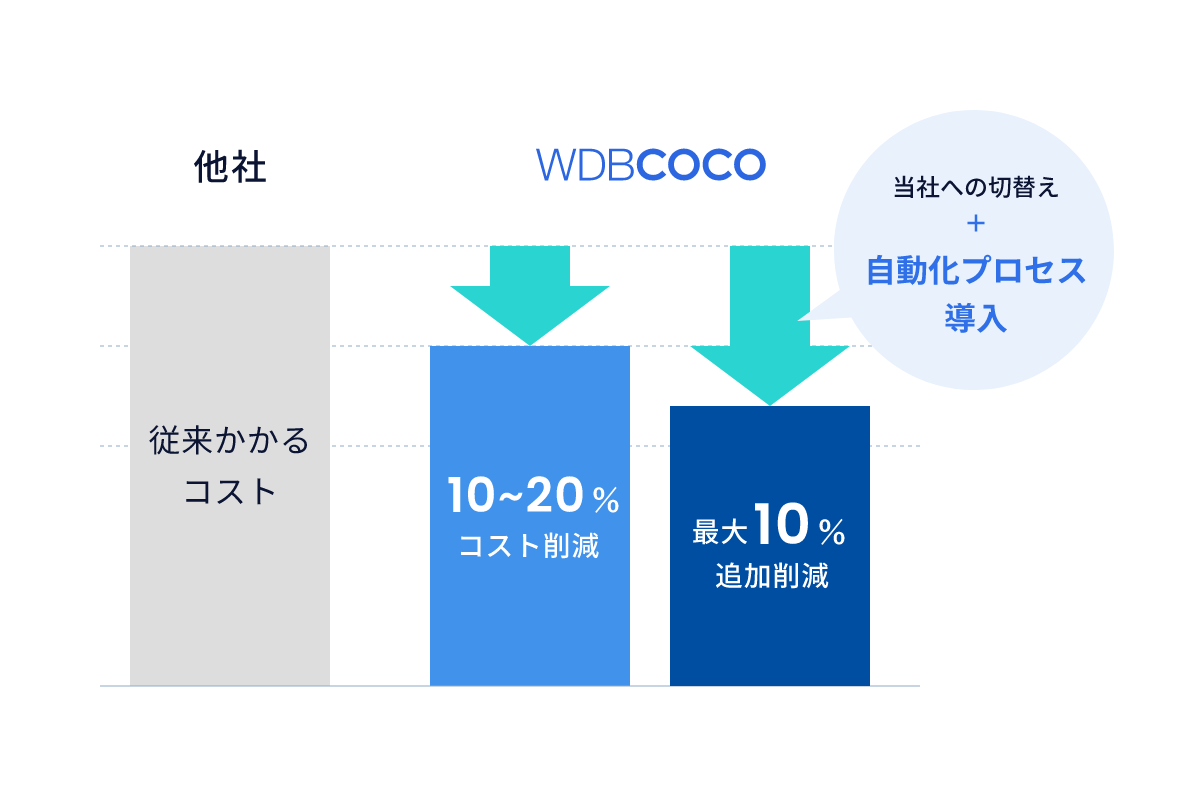
圧倒的な低コスト
標準的委託コストに対し
最大30%のコスト削減が可能
抜本的な構造変革により、標準的な委託コストに対して10~20%のコスト削減が可能です。加えて業務プロセスを変革し、DXを推進することで、さらに10%のコストを削減することができます。 ※自動化のコスト削減率は、委託業務範囲によって変動します。
Feature.03
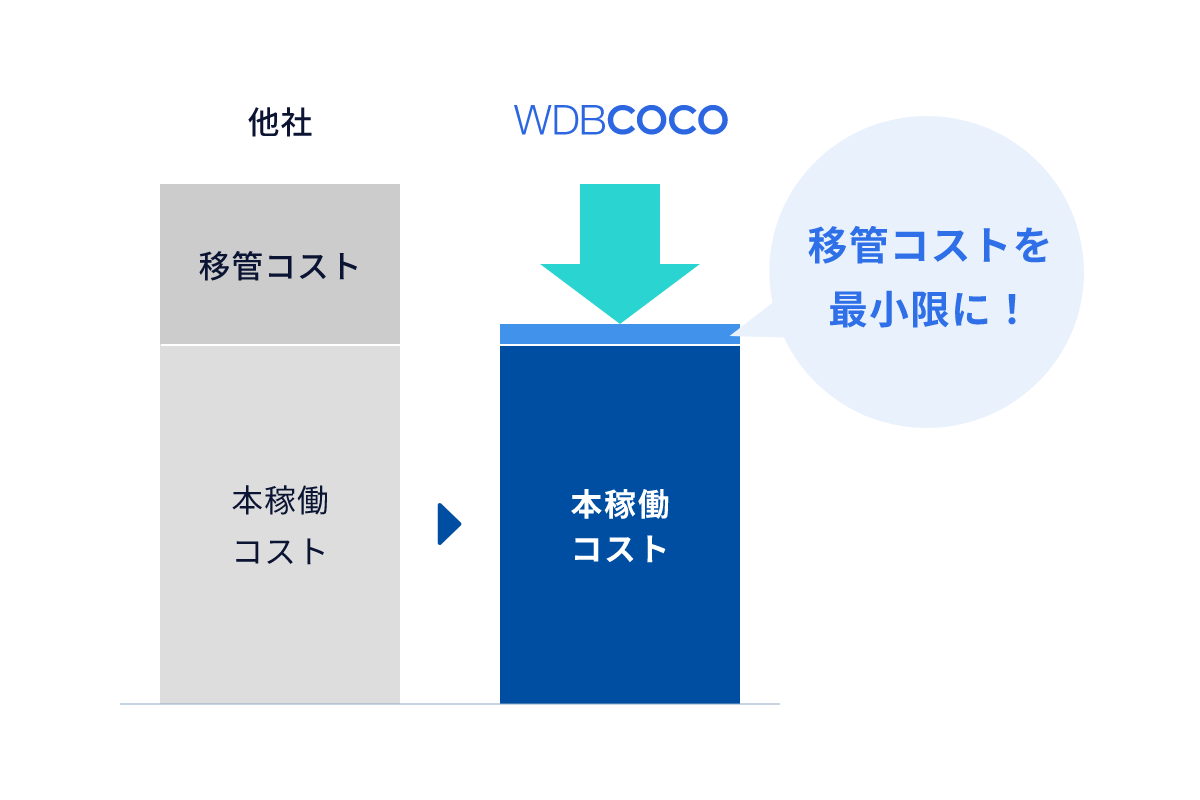
委託先切替え時のリスク補償
委託先切替え時のリスクをゼロにして
移管にかかるコストを最小限に
委託先切替え時は、新たな委託先による業務の立上げが計画通り進まないことで、品質悪化や納期遅延が起こる可能性があります。WDBココは、豊富な業務立上げ実績によるノウハウと、委託先切替え準備期間の当初から人員を豊富にアサインすることでこれらのリスクをゼロにし、トレーニング費用等の移管コストを最小限に抑え、お客様の負担を軽減します。 ※手順書・マニュアル作成費用、管理費は別途ご請求します。 ※委託先切替えの場合にのみ適用されます。
Feature.04
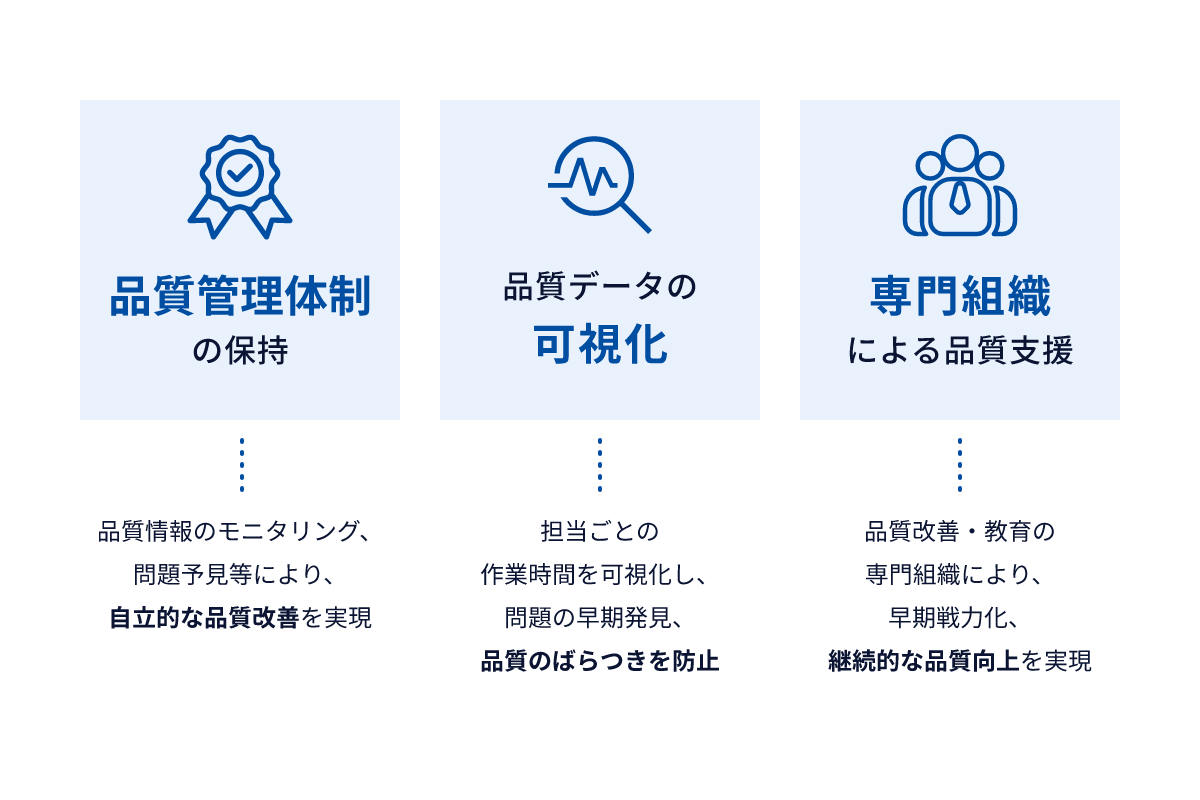
高品質の維持
高品質維持のための様々な取組み
品質管理体制の保持、品質データの可視化、専門組織による品質支援といった独自の仕組みで、高品質な受託サービスを継続的に提供します。
サービス
Service